Doç. Dr. Sevil Dinçer İşoğlu
Kanserde İlaç Hedefleme
Hedeflemede amaç kanserli hücrelerin büyümesi ve yayılmasında rol oynayan belli moleküllerin engellenmesiyle kanserin durdurulmasıdır. Bu yaklaşım geleneksel kemoterapiden farklık gösterir. Çünkü kemoterapi hastalıklı hücreler üzerinde etki gösterirken sağlıklı olanlara da zarar verir.
Kanserde ilaç hedeflenmesini nanoteknolojik yaklaşımı da düşünerek iki gruba ayırabiliriz1. Doğrudan hedefleme olarak isimlendirebileceğimiz türde küçük molekül inhibitörler ve monoklonal antikorlar hastaya direk uygulanır. Dolaylı hedeflemede ise ilaç yüklenmiş nanotaşıyıcılar, hedefleyici ajanlar ile birlikte kullanılır. Şimdi bu yaklaşımları yakından inceleyelim.
Doğrudan hedefleme
Hedeflenmiş tedavide kanserin ilerlemesi tümör büyüme ve gelişmesi için gerekli spesifik moleküllerin engellenmesi ile bloke edilir. Bu moleküllerden bazıları normal dokularda bulunan moleküller olmasına karşın, tümör hücrelerinde miktar olarak daha fazla sayıda veya mutasyona uğramış olabilirler. Hedeflenmiş kanser ajanları genel olarak monoklonal antikorlar ve küçük molekül inhibitörler olarak sınıflandırılır2.
Monoklonal antikorlar ve küçük molekül inhibitörler
Hedeflenmiş kanser tedavisinde monoklonal antikorlar hücre yüzeyindeki antijenlere bağlanırlar. Rituximab, FDA tarafından 1997’de onaylanan hedeflenmiş kanser tedavisine yönelik ilk monoklonal antikor özelliğinde ilaçtır. Tirozin kinaz aktivitesi gösteren küçük molekül inhibitörler ise hücre içi moleküllere bağlanarak tümör hücrelerini hedeflemiş olurlar.
Küçük molekül inhibitörler tümör büyümesi ve fonksiyonunda gerekli olan spesifik molekülleri inhibe eden tipte moleküllerdir. Bu inhibitörler için en dikkat çeken hedef, reseptör tirozin kinazlardır. Bu tür küçük molekül inhibitörler hücre içi tirozin kinaz sinyal iletimine müdahele ederek hücresel prosesleri engellerler.
Epidermal büyüme faktörü reseptörü (EGFR), HER2/neu ve vasküler endotel büyüme faktörü (VEGF) reseptörleri başlıca tirozin kinazlardır2. Klinik olarak onaylanmış çok sayıda inhibitör, tirozin kinaz üzerinden etki gösterir. BCR-ABL, c-KIT, PDGFR-β, Imatinib tarafından inhibe edilen tirozin kinazlardır. EGFR inhibisyonunu sağlayan FDA onaylı diğer ajanlar Gefitinib ve Erlotinib’dir.
Küçük molekül inhibitörler monoklonal antikorlardan farklı olarak ağız yoluyla hastaya verilirler. Monoklonal antikor üretiminde uygulanan üretim yöntemlerinin aksine maliyeti daha düşük kimyasal teknikler ile elde edilirler, ancak spesifiteleri daha düşüktür3,4. Ayrıca, yarı ömürleri saatler düzeyinde olduğundan günlük dozlar halinde uygulamak gerekir.
Hedefleyici kanser ajanının adına baktığımızda ilaç türü ve hücresel hedefi hakkında fikir sahibi olabiliriz. Monoklonal antikorlar “–mab” kökü ile biterken, küçük moleküllerde ismin sonuna “–ib” kökü gelir.
Ayrıca, monoklonal antikorlarda bileşiğin kaynağını belirten ek bir kök vardır, örneğin kimerik insan-fare antikorunu ifade eden “-ximab”, insanlaştırılmış fare antikoru için “-zumab”, tamamen insansı antikor için ise “-mumab” gibi. Hem monoklonal antikorlar, hem de küçük moleküllerin isminin orta kısmında moleküler hedefi belirten başka bir kısım daha vardır; örneğin, “-ci-“ dolaşım sistemi hedefli, “-tu-“ tümör hedefli monoklonal antikorları ifade ederken, “-tin-“ tirozin kinaz inhibitörü, “-zom-“ ise proteazom inhibitörünü hedefleyen küçük moleküller için kullanılır (bevacizumab, cetuximab, bortezomib, imatinib gibi)5.
Bu reseptörlerin yanı sıra, hücre yüzey belirteçlerine (CD20, CD33, CD52) yönelik antikorlar, özellikle lenfoma ve lösemi hücrelleri üzerinde bulunan hedeflenmiş tedavilerden ilk uygulananlar arasında yer almaktadır.
Buraya kadar bahsettiğimiz “doğrudan” hedefleme ile yapılan tedaviler ile oldukça iyi sonuçlar elde edilmiştir.
Imatinib, kronik miyeloid liösemi üzerinde çok büyük etki göstermiş, rituximab, sunitinib ve trastuzumab ise sırasıyla non-Hodgkin lenfoma, böbrek kanseri ve meme kanseri gibi türlerin tedavisinde çok iyi sonuçlar vermişlerdir6-8. Bu şekilde hastanın yaşam süresinin uzatılmasının yanı sıra, hedeflenmiş bu tedavi türlerinden bazılarının geleneksel kemoterapiden daha az toksik olması sebebiyle, antikanser tedavinin uygulanamadığı hastalar için bir tedavi alternatifi sunmaktadır2.
Nanotaşıyıcılar ile (dolaylı) hedefleme
Nanoteknoloji sahip olduğu üstünlükler ile sağlıklı doku ile kanserli olanın birbirinden ayırdedilme özelliğine sahip sistemlerin geliştirilmesi ile ilgili önemli potansiyele sahiptir. Nanoteknoloji sağlık alanında uygulandığında nanotıp adını alır ve bu alanda kanser tanı/tedavisinde nano ölçekte tasarlanmış parçacıklardan yararlanılır. Biz burada tedavi amacıyla çalışılmakta olan nanotaşıyıcılara değineceğiz.
Nanotaşıyıcıların ilaç salım sistemlerinde uygulanmasının çok sayıda avantajı bulunur. Kanser ilaçlarının salımında, özellikle ilaçların toksik etkisini azaltmak ve çoklu ilaç dirençliliğinin önüne geçmek gibi çok önemli iki etki sebebiyle tercih edilirler. Bu amaçla geliştirilen lipid, polimer ve inorganik bazlı olmak üzere farklı nanotaşıyıcı tipleri vardır. Polimerik nanopartiküller, polimerik miseller, dendrimerler, polimerzomlar, polimerik konjugatlar, lipozomlar, karbon nanotüpler, altın nanopartiküller en yaygın çalışılan nanotaşıyıcı türleridir. Şimdiye kadar yapılan çalışmalardan alınan sonuçlar ışığında kanser ilacı yüklenmiş nanotaşıyıcıların hedeflenmesi ile daha yüksek seçiciklikte tedavi alternatifleri ortaya çıkmıştır.
Kanserde hedefleme için tümöre etkin şekilde ulaşmak gerekir. Nanotaşıyıcı tasarlanırken tümör biyolojisinin dikkate alınması buna ulaşmak için çok önemli bir basamaktır.
Gerek tümör bölgesindeki damarsal yapıdaki farklılıklar, gerekse tümör hücreleri yüzey reseptörlerindeki değişiklikler taşıyıcı hazırlanırken göz önünde bulundurulan parametrelerdir ve bunun sonucu olarak pasif ve aktif hedefleme olarak adlandırılan yaklaşımlar ortaya çıkar. Bu şekilde, hem nanotaşıyıcının boyutundan dolayı tümör bölgesinde fiziksel olarak birikmesi sağlanır hem de direk hedeflemede bahsettiğimiz moleküler hedeflerin dahil edildiği bazı hedefleyici ajanlar nanotaşıyıcılara bağlanarak tümör öldürücü moleküllerin hedef bölgeye seçimli olarak daha yüksek miktarda ulaşması sağlanır. Şimdi bu hedefleme türlerine değinelim.
Pasif hedefleme ve EPR etkisi nedir?
EPR (enhanced permeability retention-arttırılmış geçiş ve alıkonma) etkisi ile ilaç aktarımı “pasif hedefleme” olarak adlandırılır (Şekil 1). EPR etkisi ilk kez Matsumura ve Maeda tarafından 1986 yılında tanımlanmıştır9.
Tümörlerin birçoğundaki damarsal geçirgenlik artan besin ve oksijen ihtiyacı sebebiyle daha yüksektir. Normal damar yapılarında 2 nm’den büyük moleküller sıkı bağlantılar nedeniyle endotel hücreler arasından geçemezler.
Tümör bölgesinde ise, bu sıkı bağlantı bölgeleri bozulduğundan dolayı, 10-500 nm arası boyuttaki makromoleküller dokuya geçebilir ve tümör dokusunda birikir. Bunun yanı sıra, bu bölgelerde bozulmuş lenfatik boşaltım nedeniyle de biriken moleküllerin sistem dışına çıkması zorlaşır.
Tümör bölgesindeki damarsal yapının bu özelliklerinden faydalanılarak pasif hedefleme gerçekleşir. Bu çok dikkat çekici özellik, tümör-hedefli kemoterapide bir dönüm noktası olarak kabul edilir ve antikanser ilaç geliştirilmesinde oldukça ümit vericidir10.
Pasif hedefleme yoluyla aktivite gösteren nanotaşıyıcılar ilke kez 1980’li yılların ortalarında klinik aşamaya ulaşmıştır. Lipozom ve polimer-protein konjugatı halindeki ilk ürünler 1990’lı yılların ortalarında ticarileşmiştir (Örneğin Doxil/Caelyx, DOX taşıyan PEG-lipozom).
Pasif hedefleme klinikte uygulama bulmuş olmasına karşın, bazı tümörlerde damar geçirgenlikleri farklı olduğundan EPR etkisi ile taşınım gerçekleşmeyebilir. Bu nedenle nanotaşıyıcının aktif hedeflenmesi yaklaşımı ortaya çıkmıştır.
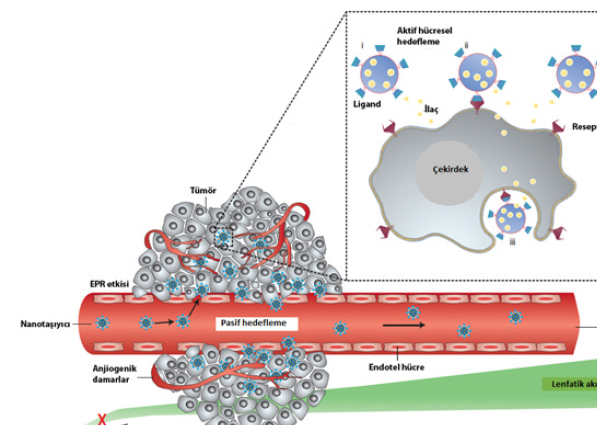
Şekil 1. Tümöre nanotaşıyıcı vasıtasıyla ilaç taşınmasında pasif ve aktif hedefleme. Macmillan Publishers Ltd. izniyle alınmıştır: [Nature Nanotechnology] (11), copyright 2015.
Aktif hedefleme nedir?
Daha önce de belirtildiği gibi tümörün besin ihtiyacı sağlıklı dokuya göre daha da artar bu da hastalıklı doku ve hücrelerde farklı reseptörlerin sayısını arttırır. Tümörlü bölge genellikle sağlıklı ve kanserli hücrelerin bir karşımı şeklinde olduğundan, bunları ayırdedebilen nanotaşıyıcıların tasarımı çok büyük önem taşır. Aktif hedeflemede, nanotaşıyıcı tümör hücre yüzeylerinde veya damar bölgesinde sağlıklı hücrelere göre daha fazla miktarda bulunan reseptörleri tanıyacak spesifik hedefleyici ligandlar ile kaplanır12. Bu şekilde antikanser ajanın sitotoksik etkisi arttırılmış, sağlıkı dokuya olan yan etkiler ise en aza indirilmiş olur. Nanotaşıyıcı üzerinde yapılan bu değişiklik aktif hedefleme sağlamakla birlikte, sitotoksik ilaçların tedavi edici etkisini arttırır ve çoklu ilaç dirençliliğini azaltır13. Seçiciliğin artması için, yüzeyde bulunan antijen veya reseptörün normal hücrelere göre daha fazla sayıda olması gerekir. Nanotaşıyıcıya bağlı ligandın reseptörü ile bağlanması sonucu reseptör-aracılı endositoz ile hücreye alım gerçekleşebilir ki (Şekil 1) bu, ilacın hücre içine salınmasında çok önemlidir.
Aktif hedeflemede moleküler hedef ve ligandlar
Nanotaşıyıcıların hedeflenmesinde kullanılan moleküler hedefler için örnekler Şekil 2 ile gösterilmektedir. Bunlar iki gruba ayrılabilir; kanser hücrelerinin yüzeyinde yüksek miktarda ifade edilen reseptörler ve tümör dokusunu besleyen damarlarda yüksek miktarda ifade edilen reseptörler12.
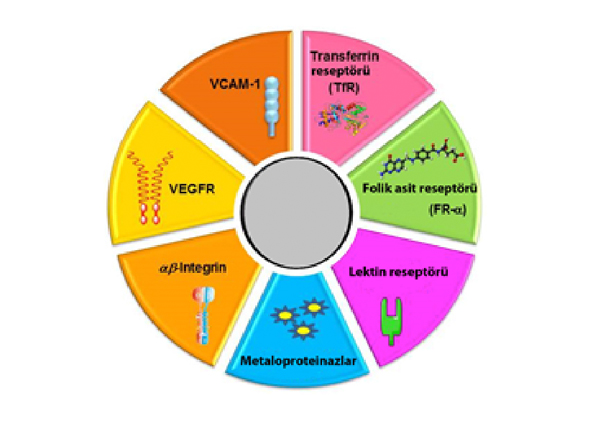
Şekil 2. Nanotaşıyıcıların aktif hedeflenmesinde kullanılan hedef moleküller.12
Kullanılan moleküler hedeflere yönelik ilk yaklaşımda antikor, protein, peptid, aptamer, şeker veya küçük moleküller (EGFR, folik asit, transferrin reseptörleri) gibi ligandlar nanotaşıyıcının yüzeyine uygun bir kimyasal yöntem ile bağlanır ve reseptör-aracılı endositoz ile sağlıklı hücrelere zarar vermeden kanserli hücre içine alınır12. Bu yaklaşım EPR etkili pasif hedefleme ile birlikte tamamlayıcı bir tedavi yöntemi olarak kabul edilir.
Bunların yanı sıra, literatürde hyaluronik asit, biotin, albümin gibi moleküllerin de ligand olarak kullanıldığını gösteren çalışmalara rastlanmaktadır14-16.
Ligand seçimi ile ilgili moleküler hedeflere yönelik ikinci yaklaşım ise, tümörü besleyen kan damarlarının hedeflenmesidir12. Yeni damarların oluşumu sırasında tümör dokudan anjiyogenezi uyaracak farklı büyüme faktörleri salınır. Nanotaşıyıcının direk olarak bu damarlara hedeflenmesi besin ve oksijen desteğini buna bağlı olarak da bu yapının bozulmasında destekleyici etki yapabilir.
Bu yaklaşımın bazı avantajları vardır. Nanotaşıyıcıların damar dışına çıkması gerekmediği gibi, tümör bölgesindeki kan damarlarında bulunan reseptörlere nanotaşıyıcının ulaşması da kolaydır. Bunun yanı sıra, damarı oluşturan endotel hücrelerin tümör hücrelerine göre mutasyona daha dayanıklı olmaları çoklu ilaç direnci riskini düşürebilir. Burada moleküler hedef olarak kullanılabilecek anjiyogenik belirteçlerden bazıları vasküler endotel büyüme faktörü reseptörü (VEGFR), vasküler hücre adezyon molekülü-1 reseptörü ((VCAM-1)R), matriks metaloproteinazlar (MMP) ve αβ-integrinlerdir12.
Geleneksel kemoterapinin yan etkilerini en aza indirme amacıyla, nanotaşıyıcılara hedefleme yaklaşımı uygulanması ile kullanımına yönelik özellikle son 10 yılda çok sayıda çalışma yapılmıştır. Bu çalışmalar içerisinde özellikle lipozomal taşıyıcılar klinik aşamaya ulaşabilen sayılı örneklerdendir17. EGFR ile hedeflenmiş DOX yüklü lipozomlar (Doxil®) metastatik yumurtalık kanseri ve ileri evre Kaposi sarkomunda uygulanmak üzere onaylanmış formülasyonlardan biridir.
Hedefleyici ligand nanotaşıyıcıya nasıl bağlanır?
Hedefleyici ajanları nanotaşıyıcı yüzeyindeki reaktif gruplara bağlamak için kovalent ve kovalent olmayan konjugasyon olarak sınıflandırılan çok sayıda yöntem bulunmaktadır. Kovalent bağlanmada, ligand ve nanotaşıyıcı arasında, tiyol-tiyol, primer amin-primer amin, karboksilik asit-primer amin, maleimid-tiyol, hidrazid-aldehit, primer amin-aldehit grupları arasında bağlanmalar yoluyla hedeflenmiş taşıyıcı elde edilir. Bu reaksiyonlar sonrasında, taşıyıcı ve hedefleyici ajan arasında fonksiyonel gruplara bağlı olarak, amid, tiyoeter, disülfit gibi karakteristik kovalent bağlar oluşur18.
Hedefleyici ajanın nanotaşıyıcı ile tamamen fiziksel biraraya gelme yoluyla bağlandığı kovalent olmayan yaklaşımın avantajı, kullanılan kimyasal veya uygulanan işlemlerin muhtemel bozucu etkilerinin en aza indirilmiş olmasıdır. Ancak, bu tür bağlanma kovalent kadar güçlü olmadığı gibi bu reaksiyonun kontrolü oldukça zor ve tekrarlanabilirliği düşüktür. Sonuçta elde edilen yapıdaki ligand oryantasyonunun gerektiği gibi olmayışı da diğer bir problemdir. Tüm bu sebeplerden dolayı, nanotaşıyıcı-ligand bağlanmasında kovalent bağlanma yaklaşımı tercih edilmektedir.
Sonuç
Günümüzde geleneksel kemoterapi kanser tedavisinde halen uygulanmakta olan önemli bir yöntem olmasına karşın, uygulanan formülasyonlar, farmakokinetik ve ilaç dirençliliği ve hastaya yan etkiler gibi problemler düşünüldüğünde tam anlamıyla tatmin edici sonuç vermediği aşikardır. Daha seçici tedavilere duyulan ihtiyaç sebebiyle, çalışmalar hedeflenmiş tedavi ajanlarının tasarımına yönelmiş, tümör büyümesi ve farklılaşmasında rol oynayan biyolojik mekanizmaları hedef alan antikanser ajanlar uygulanmaya başlanmıştır.
Nitekim, klinik olarak onaylanmış durumda olan ve direk hedefleme olarak da adlandırılabilen antikanser ilaçlar, bu tür mekanizmalar üzerinden etkinlik göstermektedir. Diğer önemli yaklaşım ise, sitotoksik ilaçların bir nanotaşıyıcı ile taşınarak, pasif ve aktif hedefleme yardımıyla tümör bölgesine iletilmesidir. Nanotaşıyıcıların kanser tedavisinde kullanımı özellikle ilaç direncinin azaltılması açısından mevcut hedefleme sistemlerine göre avantaj sunmaktadır.
Kaynaklar
- Perez-Herrero E, Fernandez-Medarde A. Advanced targeted therapies in cancer: Drug nanocarriers, the future of chemotherapy. European Journal of Pharmaceutics and Biopharmaceutics. 2015: 93; 52–79.
- Gerber D. Targeted Therapies: A New Generation of Cancer Treatments, American Family Physician. 2008; 77(3):311-319.
- Tanner JE. Designing antibodies for oncology. Cancer Metastasis Rev. 2005; 24(4):585-598.
- Imai K, Takaoka A. Comparing antibody and small-molecule therapies for cancer. Nat Rev Cancer. 2006; 6(9):714-727.
- My Cancer Genome web site. https://www.mycancergenome.org/content/molecular-medicine/overview-of-targeted-therapies-for-cancer/. Published April 26, 2016. Accessed May, 2016.
- Romond EH, Perez EA, Bryant J, ve ark. Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. N Engl J Med. 2005; 353(16):1673-1684.
- Moore MJ, Goldstein D, Hamm J, ve ark. Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol. 2007; 25(15):1960-1966.
- Willett CG, Boucher Y, di Tomaso E, ve ark. Direct evidence that the VEGF-specific antibody bevacizumab has antivascular effects in human rectal cancer. Nat. Med. 2004; 10(2):145-147.
- Matsumura Y, Maeda H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agents. Cancer Res. 1986: 46; 6387–6392.
- Fang J, Nakamura H, Maeda H. The EPR effect: Unique features of tumor blood vessels for drug delivery, factors involved, and limitations and augmentation of the effect. Advanced Drug Delivery Reviews. 2011, 63, 136–151.
- Peer D, Karp JM, Hong S, ve ark. Nanocarriers as an emerging platform for cancer therapy. Nature Nanotechnology. 2007: 2(12); 751-776.
- Martinez-Carmona M, Colilla M, Vallet-Regí M. Smart Mesoporous Nanomaterials for Antitumor Therapy. Nanomaterials 2015: 5(4); 1906-1937.
- Steichen SD, Caldorera-Moore M, Peppas N. A review of current nanoparticle and targeting moieties for the delivery of cancer therapeutics, Eur. J. Pharm. Sci. 2013: 48; 416–427.
- Choi KY, Saravanakumar G, Park JH, Park K. Hyaluronic acid-based nanocarriers for intracellular targeting: interfacial interactions with proteins in cancer. Colloids Surf. B. 2012: 99; 82–94.
- Na K, Bum Lee T, Park KH, Shin EK, Lee YB, Choi HK. Self-assembled nanoparticles of hydrophobically-modified polysaccharide bearing vitamin H as a targeted anti-cancer drug delivery system. Eur. J. Pharm. Sci. 2003; 18: 165–173.
- Frei E. Albumin binding ligands and albumin conjugate uptake by cancer cells. Diabetol. Metab. Syndr. 2011: 3; 11.
- Kumari P, Ghosh B, Biswas S. J Drug Target. 2016: 24(3); 179–191.
- Werengowska-Ciecwierz K, Wisniewski M, Terzyk AP, ve ark. Chemistry of Bioconjugation in Nanoparticles-Based Drug Delivery System. Advances in Condensed Matter Physics. 2015, Article ID 198175, 1-27.




