Seden Bedir
Rejeneratif Biyolojide Hücresizleştirme Çalışmaları
Bu hayali gerçekleştirebilmek belki yüzyıllar ötede olmayabilir. Dünyada bunu gerçekleştirmeye yönelik bir çok çalışma yapılmaktadır. Bu konuda ümit verici çalışmalar bulunmaktadır. Mesela, bu çalışmaların en enteresanlarından biri olarak birkaç yıl önce haberlere konu olan laboratuvar ortamında “yeniden üretilen” ve nakil edilen fare böbreği örnek verilebilir [1]. Yeniden üretilen diyoruz çünkü burada yeni bir rejeneratif biyoloji uygulaması olan hücresizleştirme çalışmalarını kullanılmaktadır. Hücresizleştirme süreci yapay organ üretimi için gerekli olan organ iskeleti eldesini bize sağlamaktadır.
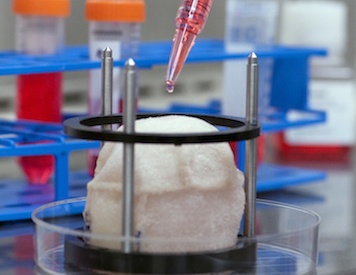
Resim 1: Kalp hücreleri bekleyen hücresizleştirilmiş doğal kalp iskeleti [2]
Peki, organ iskeletini sıfırdan üretmeye çalışmak yerine neden hücresizleşmeye ihtiyaç duyuyoruz? Bunun nedeni, günümüz şartlarında doğal iskelet yerine organ iskeletini sıfırdan üretmek fazlasıyla zor olmasıdır. Bunun temelinde hücreler besin kaynağından en fazla belirli uzaklıklarda (1-3 mm) canlılıklarını koruyabilmeleri gelmektedir. Bu mesafelerden daha uzak durumlarda karaciğer, kas gibi kalın dokuları üretmek, canlılıklarının devamını sağlamak imkansızlaşır. Doğal bir organ iskeletinde, hücrelerin beslenebilmesi için gerekli yapılar her bir hücrenin besinden faydalanabileceği yakınlıktadır, dolayısıyla doğal iskeleti yeni ve fonksiyonel hücrelerle doldurarak kullanmak günümüz yapay organ teknolojisi için etkili yöntemlerdendir. Organ hücresizleştirme işlemi, hücrelerin deterjan (temizleme ve arıtma işlemlerinde kullanılan kimyasal maddeler) içeren çeşitli kimyasallar kullanılarak organdan uzaklaştırılması sonucunda hücrelerarası iskelet elde edilmesidir (örneğin resim 1). Bu işlemin sonucunda elde edilen doğal 3 boyutlu iskelete yeni hücreler (özellikle kök hücreler) yerleştirilerek yeni hücrelerin doku oluşturması sağlanır. Kök hücreler, çeşitli hücrelere dönüşebilme kabiliyetine sahip, henüz farklılaşma göstermemiş hücre grupları olduğundan işlevini yerine getiremeyen hücreler laboratuvar ortamında kök hücrelerden üretilir. İstenilen hücreye dönüşebilme yetisi sayesinde, kök hücreler hücresizleştirme çalışmalarında önemli bir yer kaplamaktadır. [3]
Etkili bir organ hücresizleştirme kimyasal, biyolojik veya fiziksel değişik ayrıştırma tekniklerinin başarılı bir şekilde uygulanması sonucunda gerçekleştirilmektedir. Başarılı bir organ hücresizleştirme için kullanılan yöntemler doku çeşidine bağlı olarak değişir. Örneğin ince bağırsak, perikardiyum gibi ince dokular için doku dondurulur ve çözülür. Ardından dokudan kolayca uzaklaştırılabilen deterjanlar kullanılarak yıkama işlemi gerçekleştirilir. Dermis gibi kalın dokularda ise hücresel yapıların uzaklaştırılması için daha fazla biyolojik ve kimyasal maddeye ve ardından maddenin organdan uzaklaşması için daha fazla yıkamaya ihtiyaç duyulmaktadır. Pankreas ve beyin gibi yağ oranı fazla olan ve belirli şekle sahip olmayan doku ve organlar içinse hücresizleştirme işlemi sırasında lipit çözücülerin ve alkollerin eklenmesiyle sonuca ulaşılır[4].
Kimyasal organ hücresizleştirme yöntemlerinde asit ve bazlar, deterjanlar, alkoller, hipertonik ve hipotonik çeşitli kimyasallar kullanılmaktadır. Hücresizleştirmede kullanılan asit ve bazlar, biyomoleküllerin, sitoplazmik bileşenlerin hidrolitik yıkımında görev alır. Örneğin perasetik asit, özellikle yağ dokularının tüm organ hücresizleştirme işleminde sıklıkla kullanılan, antiseptik özelliğe de sahip bir asittir. Deterjan ise, organ hücresizleştirme işleminde iyonik ve iyonik olmayan deterjanlar olarak iki başlık altında incelenebilir. İyonik olmayan deterjanlar, organ hücresizleştirirken dokudaki ekstrasellüler (hücre dışı) matriks yapıya fazla zarar vermeyerek etkili bir şekilde hücreleri temizlediğinden sıklıkla kullanılan maddelerdir. Bununla birlikte, lipit-lipit ve lipit-protein molekülleri arasındaki etkileşimleri yüksek oranda temizlerken protein-protein molekülleri arasındaki etkileşimleri etkilemez. Örneğin, Triton X-100 en sık kullanılan iyonik olmayan deterjandır. Çoğunlukla ince ve hassas dokuların hücresizleştirme işlemi için kullanılır (kalp kapakçıkları ve kan damarları gibi). Bu özellikleri sayesinde, Triton X-100 lipit eliminasyonu için en etkili deterjan olarak adlandırılabilir fakat aynı zamanda ekstrasellüler matriksin önemli bileşenlerinden glikozaminoglikan (GAG) miktarını azaltır ki bu durum hücresizleştirme için istenmeyen bir durumdur[5].
İyonik deterjanlar ise hücre zarını çözerek hücre parçalama işlemine yardımcı olur ve proteinlerin denatürasyonuna yol açar. SDS (sodyum dodesil sülfat), önemli bir iyonik deterjandır ve Triton X-100’le kıyaslandığında hücresizleştirme işleminde daha etkili olduğu söylenebilir ve bu özelliklerinin sonucunda hücre yoğunluğu daha fazla olan organların (akciğer ve böbrek gibi) hücresizleştirilmesinde kullanılır. Ancak hücresizleştirmedeki etkinliğinin yanı sıra ekstrasellüler matriksteki glikozaminoglikan miktarını Triton X-100’e oranla daha fazla azaltır. Bu durum iskeletin mekanik dengesini bozan ve istenmeyen bir sonuçtur. Ayrıca, Triton X-100’den daha etkili bir hücresizleştirme deterjanı olduğundan inkübasyon süresi Triton X-100’e göre daha kısadır.
Alkoller ise hücresel yapıların uzaklaştırılmasında, hücreleri sudan mahrum bırakarak (dehidrasyon) hücre yıkımını sağlar. Lipit eliminasyonunda (depilidizasyon) en basit alkollerden metanol ve etanol kullanımı lipit eliminasyonunu sağlayan enzim lipazdan daha etkili olmasına rağmen belirli bir miktarda kullanılabilir çünkü protein çökelmesine ve ekstrasellüler matiksin hasar görmesine sebep olur. Bu sebeple lipit eliminasyonu için genellikle metanol ve kloroform karışımı solüsyonlar kullanılır. [6]
Hücresizleştirmede hipertonik ve hipotonik çözeltiler ise, organdan hücre kalıntılarının uzaklaştırılmasına yardımcı olur. Hipotonik çözeltiler hücrenin ozmotik dengesini bozarak hücre yıkımına yol açar. Bazı hipertonik çözeltiler (hipertonik salin) ise DNA’nın proteinlerden ayrılmasını sağlar.
Biyolojik yöntemlerden bahsedilince enzimlerin kullanımı sonucunda hücrelerin organdan uzaklaştırılması işlemi akla gelmelidir. Tripsin, lipazlar ve nükleazlar ( RNazlar ve DNAazlar) hücresizleştirmede başlıca kullanılan enzimler olarak gösterilebilir Enzimler doku hücresizleştirme işleminde spesifik olarak hücre kalıntılarının veya istenmeyen ekstrasellüler matriks kalıntılarının uzaklaştırılmasını sağlar. Bunun yanında, işlemler sonunda uzaklaştırılamayan enzim kalıntıları ters immün etkiye neden olabilir ve doku tekrar hücrelerle doldurulurken sorun oluşabilir[5].
Organ hücresizleştirmede kullanılan fiziksel yöntemler ise sıcaklık değişimi, kuvvet, özel bir elektroporasyon çeşidi olan NTRE (non thermal irreversible electroporation) ve basınçtır. Bu yöntemler genel olarak hücrelerin yıkımına yol açarlar ve yıkamalarla hücresizleştirme gerçekleştirilir.
Bilim insanları laboratuvarda organ oluşturma hayallerini gerçekletirmek için bir çok hücresizleştirme kullanarak bir çok organ modellemeleri gerçekleştirmişlerdir. Bunların başlıcaları arasında akciğerde hücresizleştirme, kalp, böbrek ve karaciğer hücresizleştirmesi verilebilir. Bu organlarda hücresizleştirme sonrası uygun hücreler ile doldurularak tekrar fonksiyonel olması bir ölçüde sağlanmıştır.
Akciğerde Hücresizleştirme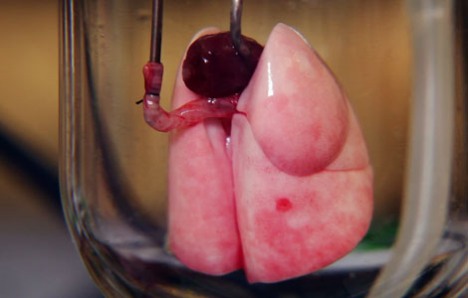
Resim 2: Yeniden hücrelendirilmiş akciğer [7]
Akciğer hastalıkları, dünyada her yıl yüzbinlerce insanın ölümüyle sonuçlanmakta ve Amerika’da 4.ölüm sebebi olarak gösterilmektedir. Akciğer, akciğer kanseri ve diğer kronik hastalıklar sonucu kendisini hücresel düzeyde yeteri kadar yenileyemediği durumlarda akciğer fonksiyon bozuklukları başlar. Akciğerin rejeneratif kabiliyetinin düşük olması sebebiyle akciğerin organ hücresizleştirme işlemiyle üretilmesine duyulan ihtiyaç artmıştır. Bunun için birkaç farklı metot öne sürülmüştür. Bu metotlardan bir tanesi fare akciğerinin Triton X-100 ve sodyum deoksikolat içerikli deterjan solüsyonuyla yıkanarak hücresizleştirilmesinden sonra alveole farklılaşacak olan embriyonik kök hücrelerin iskelete yerleştirilmesidir. Resellürizasyon adı verilen iskelete (in vivo) hücre ekiminin sonucunda embriyonik kök hücreler alveole farklılaşmıştır ve mikroskobik boyutta damarlanma (neovaskülarizasyon) gözlenmiştir. Bu gibi çalışmaların ileride klinik yaklaşımlar geliştirilmesine yardımcı olacağı beklenmektedir.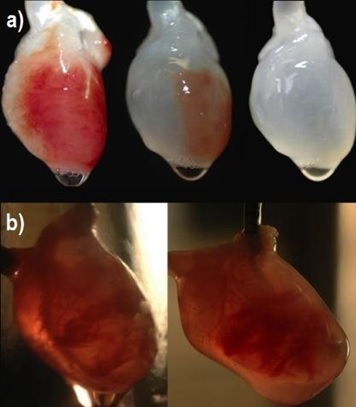
Resim 3a : Adım adım organ hücresizleştirme işlemi uygulanmış bir kalp
Resim 3b : Doğal iskeleti tekrar hücrelerle doldurma işlemi
Kalbin Hücresizleştirilmesi ve Tekrar Hücreleştirilmesi
Kalp rahatsızlıkları, dünyada ölüm sebeplerinin başında gelmektedir. Bilim insanların uzun zamandır hayalini kurduğu, hastanın kendi dokularıyla üretilmiş yapay bir kalp, kalp nakli için bekleyen hastaların ihtiyaç duyduğu tedavi olabilir. Fonksiyonel yapay bir kalp üretmek, uygun bir 3 boyutlu kardiyak iskeletin ve ihtiyaç duyulan hücresel bileşenlerin uygun metotlara uygulanması sonucunda elde edilebilir. Böylece hücresizleştirme işlemini tamamlamak için uygun deterjanlar koroner perfüzyon yöntemiyle fare kalbine uygulandı ve işlemin sonucunda ekstrasellüler matriks korundu ve hücre bulundurmayan vasküler yapılar elde edildi. Daha sonra elde edilen iskelete yeniden hücreler kazandırmak amacıyla organ gelişimi için uygun fizyolojik şartlar altında neonatal kardiyak hücreler ve fare aortik endotelyum hücreleri ekildi. İlk olarak kesik kesik kalbin kasılması gözlemlemdi. Daha sonra miyokardiyumun kasılmasıyla beraber kalbin pompa görevine ulaşması uygun elektriksel ve diğer fizyolojik uyaranlar altında bir derece gerçekleştirildi.
Böbrek Hücresizleştirmesi
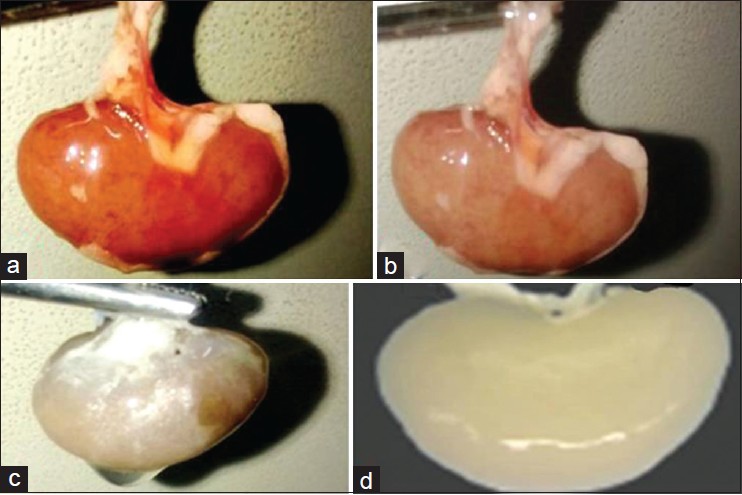
Resim 4: Adım adım hücresizleştirilen böbrek [9]
Diğer bir hücresizleştirme uygulaması da böbreklerde gerçekleştirilmiştir. İleri seviyede böbrek yetmezliğinin tedavisi ancak böbrek nakliyle yapılabilmektedir. Nakil için uygun böbreği bulamayan hastalar ömürleri boyunca diyaliz cihazına bağımlı yaşamak zorunda kalabilmektedir. Bu sebeplerden dolayı böbreğin fonksiyonel özelliklerini gösterebilen yapay böbrek üretim çalışmaları yapılmaktadır. Bu güne kadar, başta fare, domuz ve insan böbreği uygun deterjanların perfüzyonu ile böbreğin 3 boyutlu iskelet yapısı korunarak hücresizleştirilmiştir. Daha sonra hücresizleştirilen organa epitel doku hücreleri ve endotelyum hücreleri, organ gelişimi için uygun fizyolojik şartlar altındaki bir biyoreaktörde ekilmiştir. Bu işlemin sonucunda in vivo ortamda organda ilk olarak ürenin gelişmemiş bir formu tespit edilmiştir. Bunun yanında, hücreleştirilmiş böbrek fareye nakledildikten sonra farenin dolaşımıyla etkileşime girdikten sonra, in vivo ortamda amaçlanan üre üretildiği gözlemlenmiştir [10].
Karaciğer Hücresizleştirmesi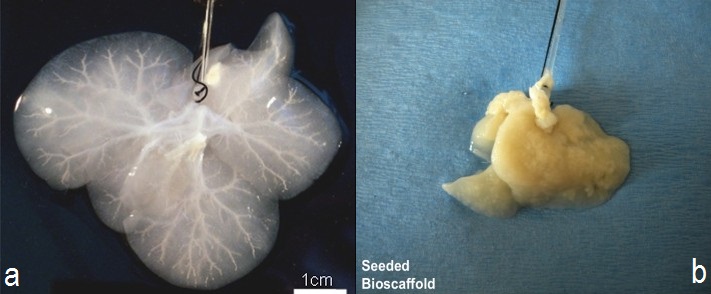
Resim 5a : Hücresizleştirilmiş bir karaciğer (desellülerizasyon)
Resim 5b : Yeni hücreler ekilmiş bir karaciğer (resellülerizasyon) [11]
Wake Forest Üniversitesi’nde bir grup araştırmacı yapay karaciğer üretmek amacıyla hayvan karaciğerlerini, fazla güçlü olmayan, yumuşak bir deterjanla hücresizleştirmeyi (desellülerizasyon) başardı. Hücresizleştirme sonucunda sadece karaciğerin iskeleti ve organı destekleyen diğer yapıları bırakıldı. Karaciğer hücrelerinin yerineyse olgunlaşmamış insan karaciğer hücreleri ve kan damarlarını kaplayacak endotel hücreleri büyük bir damar aracılığıyla iskelete ekildi. Ardından karaciğer, organ için besin ve uygun biyolojik şartların sağlandığı bir biyoreaktöre yerleştirildi. 1 hafta sonra, araştırmacılar karaciğer fonksiyonlarını gösterebilecek dokunun oluşumu gözlemlediler[12].
Sonuç olarak; yukarıda çeşitli örneklerle de belirttiğimiz üzere organ hücresizleştirme, yapay organ üretimi için gerekli temel metotların başında gelir. Yapay organ teknolojisi, gün geçtikçe farklı organ ve dokuların birer birer üretilmesiyle hızla gelişmektedir. Bu teknoloji sayesinde, organ reddi ihtimalinin organın hastanın kendi kök hücreleri ile doldurulacağından yok olmasıyla birlikte organ nakil için bekleyen hastalara umut dolu haberler verilebilir ve hastalar nakil için organ beklemek zorunda kalmayabilir.
Seden Bedir & Fatih Kocabaş
Rejeneratif Biyoloji Araştırma Laboratuvarı,
Genetik ve Biyomühendislik Bölümü, Yeditepe Üniversitesi, İstanbul
Kaynaklar:
1. Laboratuvar üretimi böbrek farede çalıştı. http://www.bbc.com/turkce/haberler/2013/04/130415_bobrek-yapay’ den alınmıştır.
2. MRS Bulletin Reviews Four Decades of Transformational Materials Developments. http://www.materials360online.com/newsDetails/42982’ den alınmıştır.
3. Baptista, P. M., Siddiqui, M. M., Lozier, G., Rodriguez, S. R., Atala, A., & Soker, S. (2011). The use of whole organ decellularization for the generation of a vascularized liver organoid. Hepatology, 53(2), 604-617.
4. Hrebikova, H., Diaz, D., & Mokry, J. (2013). Chemical decellularization: a promising approach for preparation of extracellular matrix. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub.
5. Crapo, P. M., Gilbert, T. W., & Badylak, S. F. (2011). An overview of tissue and whole organ decellularization processes. Biomaterials, 32(12), 3233-3243.
6. Brown BN, Fruend JM, Li H, Rubin PJ, Reing JE, Jeffries EM, et al. Comparison of three methods for the derivation of a biologic scaffold composed of adipose tissue extracellular matrix. Tissue Eng Part C Methods. 2010
7. How To Build A Lung? http://speakingofresearch.com/2010/06/25/how-to-build-a-lung/’ den alınmıştır.
8. University of Minnesota. "Beating Heart Created In Laboratory: Method May Revolutionize How Organ Tissues Are Developed." ScienceDaily. ScienceDaily, 14 January 2008.
9. Vishwakarma, S. K., Bhavani, P. G., Bardia, A., Abkari, A., Murthy, G. S. N., Venkateshwarulu, J., & Khan, A. A. (2014). Preparation of natural three-dimensional goat kidney scaffold for the development of bioartificial organ. Indian journal of nephrology, 24(6), 372.
10. Sullivan, D. C., Mirmalek-Sani, S. H., Deegan, D. B., Baptista, P. M., Aboushwareb, T., Atala, A., & Yoo, J. J. (2012). Decellularization methods of porcine kidneys for whole organ engineering using a high-throughput system. Biomaterials, 33(31), 7756-7764.
11. Researchers Make Miniature Human Livers In Lab. http://www.wakehealth.edu/WFIRM/’ den alınmıştır.
12. Gilbert, T. W., Sellaro, T. L., & Badylak, S. F. (2006). Decellularization of tissues and organs. Biomaterials, 27(19), 3675-3683.