Mikrobiyoloji
CAR-T VE CAR-NK HÜCRELERİ 2018 NOBEL TIP ÖDÜLÜ
T hücreleri, enfekte olmuş hücreleri veya tümör hücrelerini yok etmek için vücut içerisinde dolaşır. Bir hastalıkla karşılaşıldığı zaman enfeksiyonu ortadan kaldırır ve T bellek hücreler bu enfeksiyon faktörlerini bellekleri içerisinde tutar. Bunun amacı tekrar hastalık etkeni ile karşılaşıldığında hızlı antikor oluşturarak enfeksiyon ve hastalık etkeninin daha çabuk ortadan kaldırılmasıdır.1-2-3
Bağışıklık sisteminin iyi bir savaşçısı olan T hücreleri, kanser hücreleri ile normal bir şekilde mücadele edemez. Çünkü kanser hücreleri bağışıklık sistemi elemanlarından saklanabilir ve bu sayede kaçabilirler. Hatta bazı durumlar vardır ki bağışıklık hücrelerini kendileri için kullanırlar. Bahsettiğimiz gibi T hücreleri oldukça mücadeleci hücrelerdir fakat sorun kanser hücrelerini tanıyamamalardır. CAR-T hücre terapisi aslında bu sorunun çözümlenmesine olanak sağlayan bir immünoterapidir.1-2
İmmünoterapi, kişinin kendine ait olan bağışıklık hücresi elemanlarının kanser hücrelerinde yüksek spesifiteye sahip ve hedefe yönelik olarak kullanılmasıdır. CAR-T hücreleri ise laboratuvar ortamında (ex vivo) üretilmiş sentetik reseptörlerdir. Genetik mühendisliği uygulamaları ile CAR-T (Kimerik antijen reseptör T), T hücrelerine spesifik bir proteini hedefleme başarısı sağlar. Bu hücreler kanser hücreleri üzerindeki hedeflenen antijenleri spesifik olarak tanıyarak kanser hücrelerini başarılı bir şekilde ortadan kaldırma yeteneğine sahiptir. Bu hücreler hasta kişinin vücuduna verildiğinde sadece kanser hücresini tanıyarak öldüren eğitimli hücrelerdir. Ayrıca T hücreleri bireyden alınıp modifiye edildikten sonra tekrar aynı bireye verildiği için doku uyuşmazlığı gibi sorunların da önüne geçilmiş olur.1-4

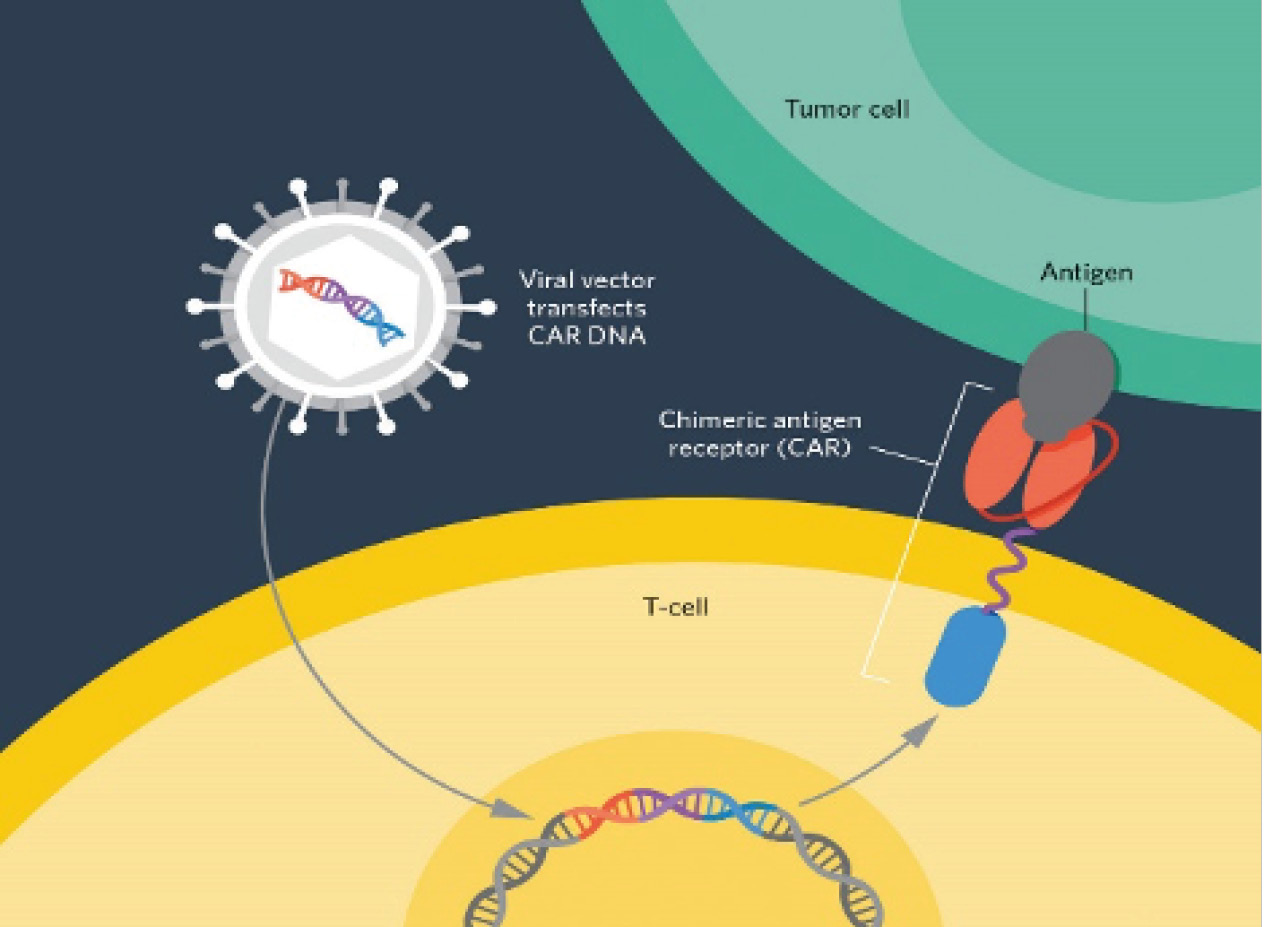
Şekil-1 Şekil-2
(Şekil 1 ve 2’ de CAR-T Hücre yapısı gösterilmiştir.)
CAR-T Hücreleri, antijen tanıyan kısım ve tek zincirli değişken antikor parçası (scFv) ‘ndan oluşan bir yapay füzyon proteinidir. ScFv, kanser hücresi üzerinde bulunan, kansere spesifik olarak eksprese edilen antijeni tanır ve aktifleşerek hücre içerisine sinyal göndermesi için bir T hücre reseptörü olan CD3zeta parçası ve CD28 veya CD137 proteinleri ile birleştirilerek CAR-T hücrelerinin aktifleşme, çoğalma ve hayatta kalma etkinliklerini arttırırlar. Sinyalleşme alanı sayılarına göre birinci, ikinci ve üçüncü nesil olarak adlandırılabilirler. Birinci nesil CD3zeta sinyalleşme proteinin içerirken ikinci nesil CD3 zincirine ek olarak CD28 veya 4-1BB sinyalleşme proteinlerini içerebilir. İkinci nesil CAR’lar daha güçlü sitokin üretme ve sitolitik kapasiteye sahiptirler ayrıca klinikte en çok tercih edilen ikinci nesil sinyalleşme proteinleridir. Üçüncü nesil ise CD3zeta’ya ek olarak CD28 ve 4-1BB(CD137) proteinlerini birlikte taşırlar. En yaygın olarak kullanılan sinyalleşme alanları; CD3, CD28, 4-1BB, OX40 ve ICOS’dur (kostimülatörler). Reseptörün spacer (aralayıcı) ve transmembran bölgeleri ise hücre dışında antijen tanıyan domaini, sitoplazmik sinyal proteinlerine bağlamaktadır. 2-3
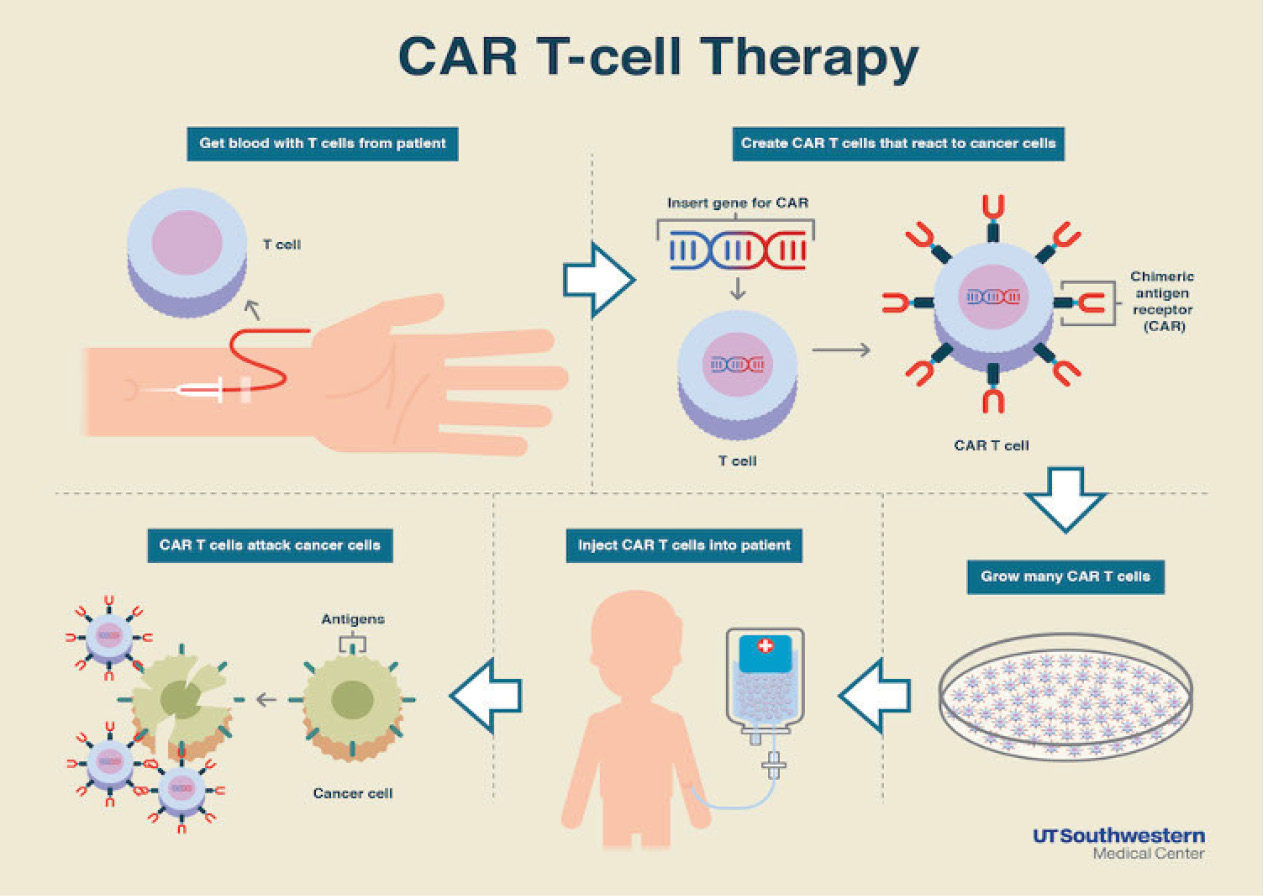
Şekil-3
(Şekil-3’te CAR-T Hücre Terapisinin aşamaları gösterilmiştir.)
CAR-T Hücreleri ex-vivo olarak üretme sürecine başlanırken ilk olarak, hasta bireyden T hücreleri aferez yoluyla toplanır ve ayrıştırılır. Antijen sunan hücre görevi gören yapay dendritik hücreleri ile T-hücrelerinin aktivasyonu sağlanır. CAR yapısını kodlayan gen, gen aktarımı (transdüksiyon) süreci ile T-hücresinin genomuna retrovirüs, lentivirüs veya transpozon gibi gen aktarma vektörleri ile transfer edilir. T hücreleri bu sayede ex-vivo yeniden programlanır. Genetik olarak modifikasyona uğratılan aktif T-hücreleri ex-vivo olarak daha fazla çoğaltılır. Hastaya CAR-T hücreleri verilmeden önce kemoterapi yoluyla lenfositleri azaltılır bu sayede hastaya hazırlama rejimi uygulanmış olur. CAR-T hücreleri damar yolu ile hastaya verilir.4
CAR-T hücreleri yıllarca vücutta kalma kabiliyetine sahiptir. Bu da ileride tekrar kanserin nüks etme durumuna karşı bir önlemdir. Bu hücreler kanserleşme sürecinin ilk aşamasında kanser hücreleri ile savaşarak kontrolsüz çoğalan hücrelerin daha fazla çoğalması ve göç etmesine engel olurlar.1-4
CAR-T hücre tedavisi genellikle hematolojik kanser türlerinde kullanılır. Bunlar; Akut Lenfoblastik Lösemi (ALL), Kronik Lenfoblastik Lösemi (KLL), Lenfome ve Multipl Miyelom (Kemik iliği kanseri). Hematolojik olmayan, solid kanserlere göre hematolojik kanserlerde başarı şansı daha yüksektir. Çünkü solid kanserler için tek tek tümör antijenlerinin tanımlanması ve CAR-T hücrelerinin kana değil direkt olarak tümör dokusu çevresine verilmesi gerektiğinden dolayı daha zahmetli ve daha maliyetli bir işlemdir. Gelecek yıllarda CAR-T hücrelerinin solid tümörlerde başarı oranının arttırılması için yeni ajanlar ve genetik mühendisliği uygulamaları ile yeni vektör dizaynlarının, CRISPR/CAS9 yönteminin gelişmesiyle beraber daha etkili vektörlerin geliştirilmesi hedeflenebilir. CAR-T hücresinin hedef antijen repertuvarı genişletilebilir. Bu sonuçlar sonunda hedefe yönelik tedavide bilim açısından çığır açan sonuçlar ortaya konabilir.6-7
Genetik mühendisliği uygulamaları ile T hücrelerine eklenen CAR’lar kanser hücrelerinin ifade ettiği spesifik antijenlerin tanınma spesifitesini ve yeteneğini arttırırlar. Fakar CAR-T hücrelerinde önemli bir dezavantaj bulunur. Hastadan alınan T hücresi baika bir hastada kullanılamaz. Çünkü doku uyuşmazlığı riski vardır. Her hasta için özel olarak T hücreleri modifiye edilir. Bu hastalığı ilerlemiş durumda olan hastalar için zaman kaybıdır ve maliyetli bir süreçtir. Ayrıca hastada yeterli T hücresi olmama durumunda tedavi için olumsuz durumlar ortaya çıkmış olur. Hastaya tedavi uygulanamaz ve istenmeyen sonuçlar ile karşılaşılarak hastanın hayatı son bulabilir. Bu sebeple bağışıklık sisteminde farklı bu durumların ortadan kaldırılacağı hücrelere yoğunlaşılmıştır. Bağışıklık sistemi doğal elemanı olan NK (doğal katil hücreler)’lar yeni bir tedavi imkânı ortaya çıkarmıştır. NK’lar, enfekte olmuş kötü huylu hücreleri tanıyarak ortamdan elimine etme yeteneğine sahip bağışıklık sistemi lenfositleridir. NK hücreleri belirli bir antijenin ekspresyonundan bağımsız, birçok hücreye karşı aktive edilebilme yeteneğine sahiptir. NK hücreleri, T hücrelerinin aksine allojenik olarak hasta bireye verilebilir. Verilen hastada doku uyuşmazlığı gibi problemler ile karşılaşılmaz. 5-6-7
Göbek kordon kanından, kemik iliğinden NK hücreleri ayrıştırılır ve tüm hastalar için kullanılmak üzere saklanır. Bu da hastaların tedaviyi alma süreçlerinde beklemelerini ortadan kaldırmış olur.6-7
Kordon kanından toplanan NK hücrelerine belirli fonksiyonlara sahip birkaç gen sokulma sürecinde transdüksiyon yöntemi ile NK hücrelerinin DNA’sına retroviral vektörler kullanılarak hücrelere yeni özelliklerini kazandırırlar. Bu özellikler, maligniteler için ayırt edici özelliğe sahip CD19 yüzey proteini. CD19, CAR-NK hücrelerinin spesifitesini arttırır. Ayrıca hücre çoğalması ve hayatta kalma şansının arttırılması için IL15 eklenir.IL15, CAR-NK hücreleri vücut içerisindeki varlığını uzatır. Bu gen olmadan CAR-NK’lar vücuda verilirse hücreler dolaşımda iki hafta içerisinde yok olurlar.7
Son olarak, CAR-NK hücreleri eğer vücutta bir toksisiteye yol açacak olursa hücrenin kendisini ortadan kaldırması için CAR-NK hücrelerine apoptozu indükleyen CASP9-temelli “intihar geni” eklenir.7
CD19, IL15 ve CASP9 eklenmiş CAR-NK hücrelerinin bir lenfoma modelinde denendikten sonra önemli sonuçlar kaydedilmiştir. Önemli ölçüde iyi proliferasyonu sergilemiş ve bunun yanında tümör dokusunun inhibisyonu ve hayatta kalma süresi oldukça yüksek olduğu gösterilmiştir.7
NK hücreleri kordon bankasından toplandıktan sonra genetik mühendisliği ile modifiye edilir. Hastaya verilmek üzere saklanmaya alınır. Hastaya uygulanmadan önce hastanın vücudu tedavi için hazırlanır. Hazırlama sürecimde hastaya kemoterapi uygulanır. Kemoterapi ilacı olarak hastaya siklofosfamid ve fludarabin verilir. Kemoterapi aldıktan iki gün sonra dizayn edilmiş CAR-NK hücreleri damar yoluyla hastaya verilir.
CAR-NK, hematolojik kanserleri hedef alan bir tedavi yöntemidir. CAR-T hücreleri gibi CAR-NK’da Multipl Miyelom, akut miyelojenöz lösemi ve miyelodiplastik gibi hematolojik kanserleri hedef alır. CAR-T hücrelerinde olduğu gibi CAR-NK’da en büyük sorun solid tümörleri hedef almaktır. Önümüzdeki yıllarda bu terapi yöntemlerinin solid tümörler üzerinde de işe yaraması ve antijen tanıma repertuvarlarının genişletilmesi temel amaçlar arasında olmalıdır.7
2018 NOBEL TIP ÖDÜLÜ- “Bağışıklığın negatif düzenlenmesinin baskılanmasıyla kanser tedavisi konusundaki keşifler” (James P. Allison ve Tasuku Honjo)
Kanser, normal hücrelerimizin fonksiyonlarının bozulması ve hücrelerin kontrolsüz çoğalmaları sonucu ortaya çıkan dünyada ölümlerin birçoğunun sebebi olan bir hastalıktır.
Bağışıklık sistemimiz iç homeostazımızın korunmasını sağlayan, kendinden olmayan hücreleri bularak fagosite ederek ortamdan eleyen birçok hücre elemanına sahip karmaşık bir ağdır. Fakat bağışıklık sistemimiz için kanserin tanınması oldukça karmaşık ve zorlu bir süreçtir. Kanser hücreleri bağışıklık sistemi hücrelerimizden kaçmak ve saklanmak gibi yeteneklere sahiptir. Bu da bağışıklık sistemimiz için zorlu bir süreçtir. Temel olarak bağışıklık sistemi, tümör dokusu üzerinde bulunan antijenler tanımalı ve bağışıklık yanıtını oluşturmalıdır. Burada en önemli bağışıklık hücre elemanı T hücreleridir. Tümör hücrelerinin tanınması ve doğrudan öldürülmesi için en etkin hücredir.8
Bağışıklık sistemimizin kanser hücreleri ile savaşma sürecinde en etkin oldukları evre, hücrelerde kanserleşmenin yeni başladığı ilk evredir. Çünkü kanserleşme devam ettikçe ve bağışıklık hücreleri tarafından bastırılamazsa hücrelerde genetik değişimler sonucu bağışıklık sistemi hücrelerini baskılayabilirler ve onlardan kaçabilirler.8
İmmün sistemin kendini kontrol etmekte kullandığı bir fren sistemi vardır. Bağışıklık sistemi hücrelerimiz kendinden olmayanı ayırt ederek yabancı hücreyi yok etme mekanizmasına sahiptir. Bağışıklık sisteminin en etkin savunma hücresi olan T hücresi bir yabancı ile karşılaşınca lenf düğümlerinde MHC molekülü tarafından sunulan antijeni T hücre reseptörü adı verilen protein yapıda olan bir molekül ile tanır. Bu şekilde T hücresine ilk sinyal gönderilmiş olur. İkinci sinyal ise T hücresinin yüzeyinde bulunan CD28 molekülünün antijen sunan hücre üzerindeki B7 molekülüne bağlanmasıyla gerçekleşir. Aktive olan T hücresi hızlıca savaşacağı dokuya gider ve saldırmaya başlar. Bu süreçte pozitif ve negatif düzenlenmeler vardır. Pozitif düzenlenmeler T hücresinin daha agresif ve saldırgan hale getirir fakat bu kendinden olan hücrelere ve dokulara zarar vermesine neden olabilir. Burada devreye negatif düzenlenmeler girer. Negatif düzenlenmeler hücrede fren sistemi görevi görür. T hücresinde bu fren görevi gören protein CTLA-4’dür. Nobel Ödülü verilen alan araştırmada kanser hücrelerine yönelik değil bağışıklık hücrelerine yöneliktir. Bağışıklık sistemi hücrelerinde fren görevi gören sistemi geçici süreyle durdurulması amaçlanmıştır. Böylece aktivasyonun devamlılığı hedeflenir. Bu tedavi tek bir kanser tipine yönelik değil her tip kanser için tedaviyi destekler. 8-9
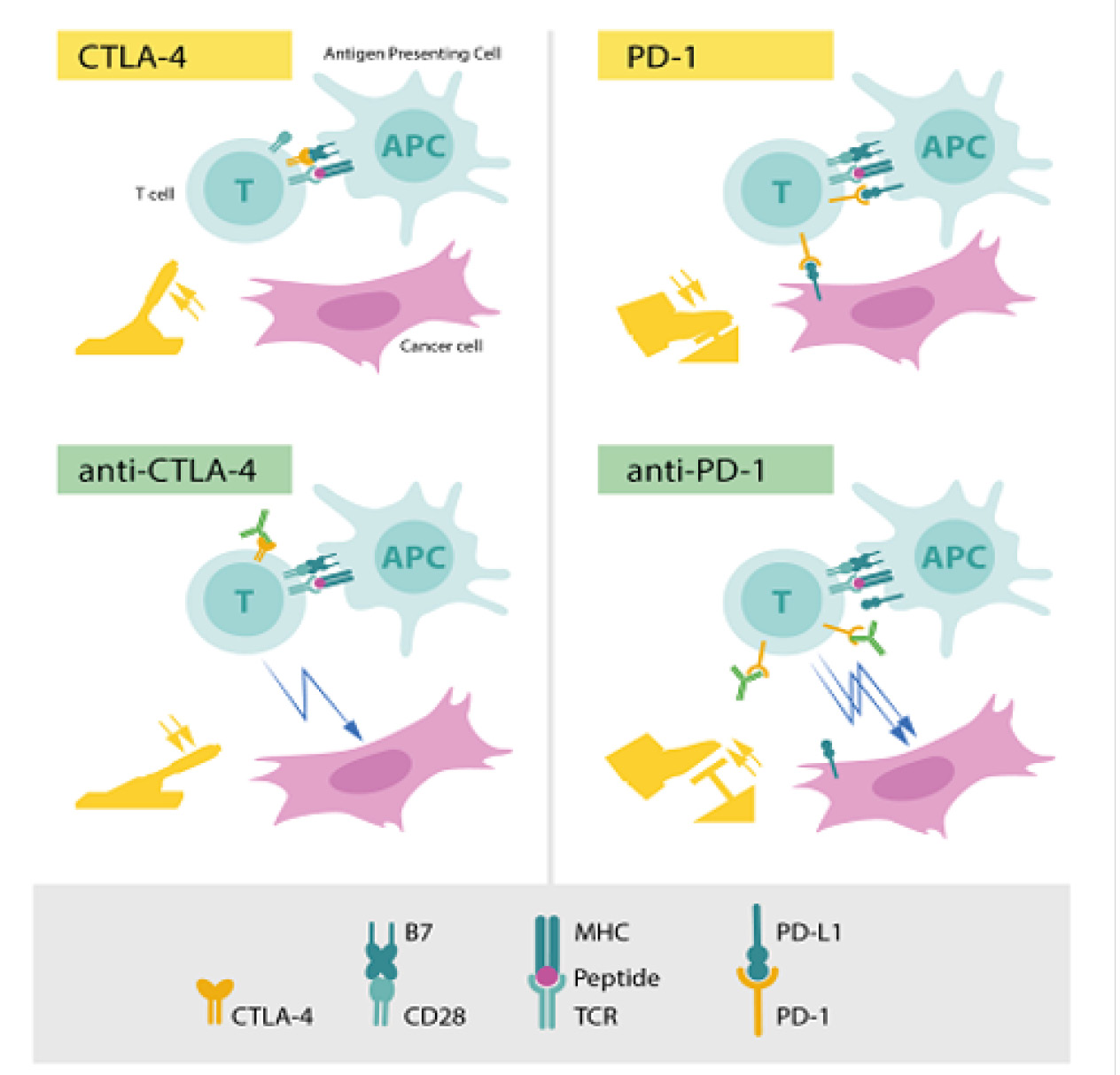
Bağışıklık sisteminde yer alan fren moleküllerini ortadan kaldırmak temel amaçtır. İlk olarak James P. Allison fren görevi gören CTLA-4 proteinini bloklayan bir antikor geliştirdi ve fareleri CTLA-4 blokajı yapan antikor ile tedavi etti. Farelerde kanserin yok olduğunu gösterdi. İnsanlar üzerinde çalışmaya malign melanom ile başlandı ve olumlu sonuçlar elde edildi. Tedavide hastaya ilaç verildiği sürece kanserle savaşan bağışıklık sistemi önündeki engeller kaldırıldı.8
Tasuku Honjo ise bulduğu PD-1 molekülünün fonksiyonlarını tanımladı ve bu proteinin de CTLA-4 gibi fren işlevi gördüğünü fakat mekanizmalarının birbirinden farklı olarak çalıştığını gösterdi. PD-1’i bloklayan ilaçlar kanser tedavisinde olumlu sonuçlar gösterdi. Önce farelerde ve sonra klinik çalışmalarda olumlu sonuçlara ulaşıldı. İyileşmesi mümkün görülmeyen metastatik tümörler dahil uzun süreli tedavilere cevap alındı.8
Bu tedaviler sonucunda iyileşmesi mümkün olmayan kanser hastaları yaşam sürelerinin uzatılmasının mümkün olduğu görüldü.8-9
İmmün kontrol noktalarının bloklanmasına dayalı birçok yeni tedavi geliştiriliyor ve ilerleyen yıllarda geliştirilen kontrol noktalarının bloklanmasına dayalı olan tedavi şeklinin tüm kanser tiplerinde uygulanabileceği ve öyle ki immün yetersizlikler için bile bir umut ışığı olabileceği düşünüyorum. Destekleyici tedaviler ile hastalara büyük umutlar vaad eden daha birçok çalışma ile karşılaşmamız çok uzak değil.
Şekil-4
(Şekil-4’te Nobel Ödüllü çalışmanın genel mekanizması gösterilmiştir.)
Kaynaklar:
1- http://static.dergipark.org.tr/article-download/3a08/04b8/13b2/5dc289449d0cf.pdf?
4- Sahin Gören, D., Akay, O.M. (2019). Kimerik Antijen Reseptör-T-Hücre Tedavisi. Türkiye Klinikleri J Intern Med. DOI: 10.5336/intermed.2019-65589
6- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5941700/
8- https://www.nobelprize.org/prizes/medicine/2018/press-release/
9- https://sarkac.org/2018/10/kanser-tedavisinde-bagisiklik-sistemi/
Fatma Nur MUTLU




