Haberler
EPİGENETİK
Epigenetik, DNA dizisinde herhangi bir değişiklik olmamasına rağmen gen ekspresyon profilindeki değişimlerin incelenmesidir. DNA veya histon proteinlerinin kimyasal modifikasyonundan kaynaklanan gen ekspresyonundaki değişimler epigenetik değişimler sonucu ortaya çıkmaktadır. Ayrıca beslenme ve stres gibi çevresel faktörlerin etkisi ile de epigenetik düzenlenmeler fenotipte kalıcı değişimlere neden olmaktadır. Her hücre aynı DNA’ya sahip olmasına rağmen her hücrenin ekspresyon paternleri birbirinden farklıdır. Üç farklı epigenetik mekanizma tanımlanmıştır. Bu mekanizmalar, DNA metilasyonu, histon modifikasyonu ve dolaylı yoldan epigenetik etkiye sahip olan posttranskripsiyonel mekanizmalar (mRNA sessizleştirilmesi). 1-2
DNA (Deoksiribo Nükleik asit), genetik bilgiyi üzerinde barındıran ve binlerce genden oluşan bir moleküldür. Üzerinde genetik bilgiyi barındırdığından dolayı çift sarmal yapı ona stabilite sağlar. DNA dört adet nükleotit içermektedir. Bunlar, Adenin (A), Guanin (G), Sitozin (C) ve Timin (T)’dir. DNA metilasyonu, DNA’nın yapısına bir metil (-CH3) grubunun eklendiği kimyasal bir süreçtir. DNA metilasyonu, genomdaki Sitozin (C) ve Guanin (G) çiftlerinin ard arda sıralanması ile oluşan CpG dizilerinin yoğunlaştığı yerlerde gerçekleşir.
Buralara CpG adacıkları denmektedir.
Özellikle tekrar dizilerinde ve transpozonlar gibi heterokromatin bölgelerindeki metillenme oranları oldukça yüksektir. DNA metillenmesi metil grubu donörü olan DNA metil transferazlar (DNMT) tarafından katalizlenmektedir. DNMT’ler S-adenozil-L-metiyonin (SAM)’den metil grubu alarak Sitozin (C)’in 5.karbonuna transfer eder. Sitozin (C) bazının 5.karbonuna transfer edilen metil grubu (5m-C) yapısını oluşturur. Yüksek spesifiteye sahiptir ve her zaman CpG adacıklarında gerçekleşir. CpG adacıkları sık olarak bir genin promotor kısmında görülmektedir. Burada gerçekleşen bir metilasyon promotor kısmına transkripsiyon faktörlerinin bağlanamaması sonucunda gen ifadesinin susturulmasına neden olmaktadır. DNA metilasyonu, X kromozomu inaktivasyonu, karsinogenez ve yaşlanma ile oldukça ilişkilidir. Metilasyonda meydana gelen değişiklikler ve aksaklıklar sonucu bazı hastalıklar ortaya çıkabilmektedir. Zihinsel gerilik bozukluğu ile karakterize olan Prader-Willi ve Angelman sendromları DNA metilasyonundaki değişikliklerden kaynaklanmaktadır. Bunun dışında kanser gelişiminde önemli bir bileşen olarak DNA metilasyonu kabul edilmiştir.3-4-5
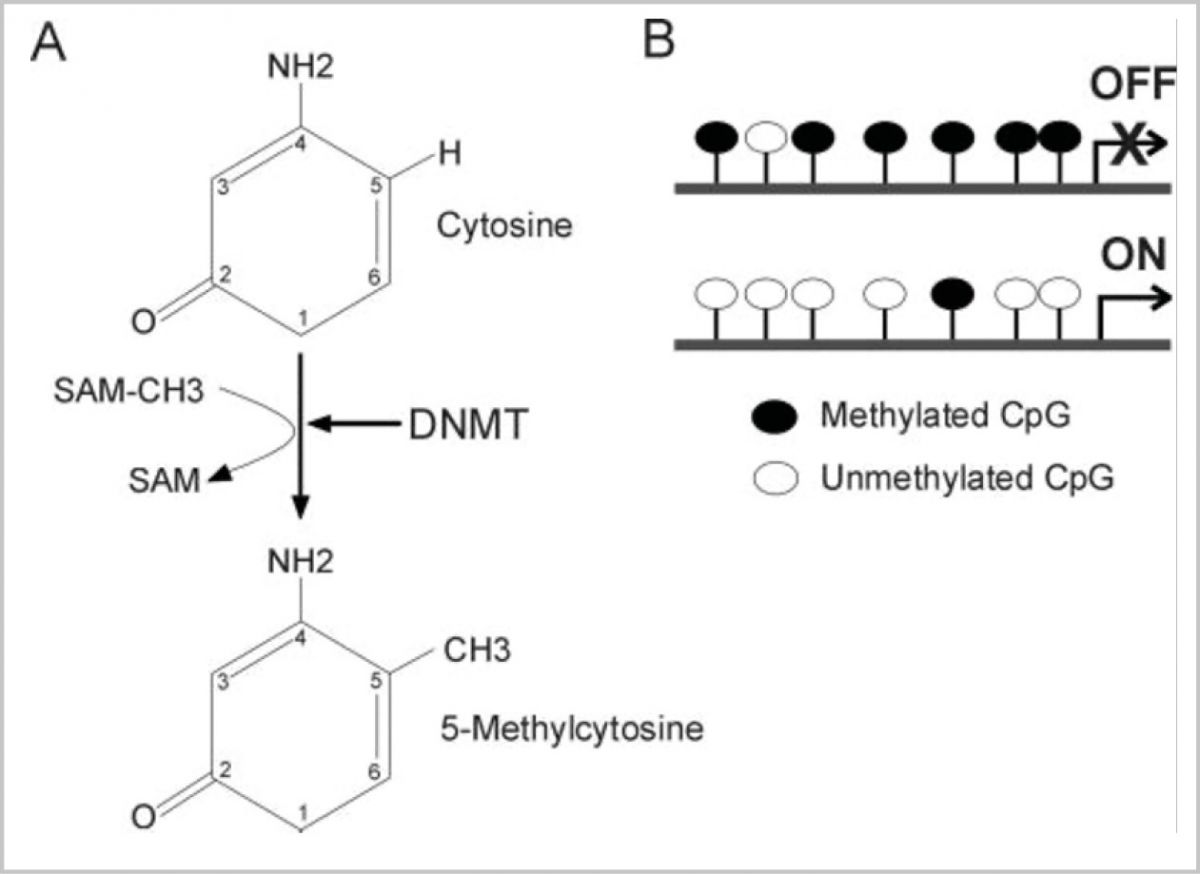
(Şekil-1’de DNA metilasyon mekanizması gösterilmiştir. DNMT’ler tarafından katalizlenen reaksiyon SAM’den bir -CH3 grubu alarak sitozine ekler ve bunun sonucunda 5-Metilsitozin elde edilir. Bu işlem sonucunda gen ekspresyonu inaktivasyonu gösterilmiştir (B). Collas, P. (2008). Epigenetic Basis for the Differentiation Potential of Mesenchymal and Embryonic Stem Cells. Transfusion Medicine and Hemotherapy 35(3):205-215. DOI: 10.1159/000127449)
Memelilerde gerçekleşen DNA metilasyonları büyük ölçüde silinir ve nesiller arasında yeniden oluşur. Ebeveynlerdeki tüm DNA metilasyonları gametogenez ve erken embriyogenez de demetilasyon ve remetilasyona uğrayarak silinir. 10
DNA histon proteinleri sayesinde yoğunlaşarak çekirdeğin içine sığması ve yoğunlaşması sağlanır. Histonların pozitif yüklü olması negatif yüke sahip DNA ile birleşmesini sağlar. DNA paketlenip düzenlenerek nükleozom adi verilen birimlere ayrılır. DNA çift ipliği ile nükleozomun yapısına katılan histon proteinleri H2A, H2B, H3 ve H4 ‘den oluşmaktadır. 7 Bu proteinler ile DNA iki tam dönüş yaptıktan sonra H1 histon proteini ile yapıyı kitlerler. Bu sayede DNA çekirdek içine sığabilir bir hale getirilir. Epigenetik değişimlerden DNA’nın etkilendiği gibi histon proteinleri de etkilenmektedir. Bu değişimlere Histon Modifikasyonları denir. Histon modifikasyonları, histon asetilasyonu, metilasyonu, fosforilasyonu ve ubikitinasyon gibi klasik epigenetik mekanizmaları temsil etmektedir. En çok incelenen histon modifikasyonu asetilasyondur. Asetilasyon temel olarak nükleozomdan uzanan N-terminal H3 ve H4 histon kuyruklarında bulunan lizin tortularına histon asetiltramsferazlar (HAT) negatif yük ekleyerek negatif yüke sahip olan DNA’yı iter ve bu sayede histonlar ile DNA arasındaki bağlar gevşer (DNA’da açık renkli bulunan gevşek paketlenmiş ökromatin yapısı gözlemlenir) ve transkripsiyon faktörlerinin bağlanmasına izin vererek gen ekspresyonunu bu sayede arttırmış olur. Genellikler genlerin promotor bölgelerine yönelik asetillenme gerçekleşir. Histon asetilasyonu hücre ile alakalı birçok süreçte önemli bir role sahiptir. Bu süreçteki dengesizlikler tümör oluşumu ve ilerlemesi ile sıkı bir ilişkiye sahiptir. Histon asetiltransferazlar (HAT) ile ilave edilen negatif yükler deasetilazlar (HDAC) ile çıkarılır. Histon Metilasyonunda ise S-adenosil-L-metiyoninden H3 ve H4 histonlarının lisin veya arginin tortularına histon metil transferazlar (HMT’ler) ise bir, iki veya üç metil grubunun eklenmesi ile ortaya çıkmaktadır. Bu işlem sonucunda DNA’da daha sıkı paketlenme gözlenir ve koyu heterokromatin bölgesi oluşur. Bu bölge transkripsiyon faktörlerinin bağlanmasını etkiler ve genin ifadesini zorlaştırır. Son olarak post-transkripsiyonel mekanizmalar da ise kodlama yapmayan RNA’ların (miRNA, siRNA vb.) mRNA’yı etkileyerek protein sentezini engellemesinden dolayı epigenetik değişimler meydana gelir. 7-8
Epigenetik düzenlenmeler sırasında meydana gelen sorunlar sonucunda kanser, nörolojik hastalıklar ve gelişim bozukluğuna neden olan hastalıklar ortaya çıkabilmektedir. Epigenetik değişimlerin çevresel faktörler ile arasında sıkı bir ilişki mevcuttur. Epigenetik değişimler kararlı ve dinamik bir yapıya sahiptir. Epigenetik düzenlenmeler bir sonraki jenerasyona aktartılırken embriyonik dönüşümler ile tüm genom silinir ve yeniden oluşturulur. Fakat epigenetik yeniden düzenlenmelerden kaçan epigenetik değişimler bir sonraki jenerasyona aktarılabilir. Epigenetik kaçış mekanizmaları ile kaçan genlere örnek olarak tek allelin ifade edildiği imprint genler ve bazı lokuslarda çevresel etkiler ile meydana gelen epigenetik değişimler verilebilmektedir. Özellikle bu kaçışlar preimpilantasyon döneminde gerçekleşir İmprint genlerinde korunmuş olan epigenetik modeller preimpilantasyon programından kaçar ve yeni jenerasyonlara mayoz yolu ile aktarılır ve canlının somatik hattında korunmaktadır. Erken embriyonik dönemde yüksek oranda ifade edilen bir maternal faktör olan STELLA imprint bölgelerinde histon H3 lizin 9 dimetile bölgelerine bağlanır. Demetilasyon sürecini yürüten enzim TET (Ten- eleven translocation) enziminin bağlanmasını engeller ve demetilasyondan korur. Ayrıca Intrasisternal A partikülleri (IAP), epigenetik programlamadan kaçışta önemli bir mekanizmadır. IAP dizileri demetilasyona dirençli dizilerdir ve bulundukları bölgeleri metilasyondan korumaktadır. Önceden maruz kalınmış bir gelişimsel ya da çevresel uyaran tarafından tetiklenen ve gen ifadesinin kalıtımsal değişimlerini kapsamaktadır buna da Epigenetik hafıza denmektedir. Epigenetik hafızanın kontrolü DNA metilasyonuna göre daha dinamik olan histon modifikasyonları ile kontrol edilir. Örneğin hamilelerde stres gibi çevresel bir faktörün etkisi altında kalındığında anne ile birlikte uterus çevresi ve plasenta arasında direkt olarak fetüsü etkiler ve epigenetik düzenlemelere neden olmaktadır. Bunun yanında somatik hücrelerden germ hücrelerine epigenetik değişimlerin geçmesi kodlama yapmayan RNA’lar ve hormonlar tarafından olduğu düşünülmektedir. 10
KANSER VE EPİGENETİK
CpG adalarının anormal hipermetilasyonu ile kromozomal instabilite ve genler üzerinde baskı kaybı ile bağlantılı bulunmuştur.
Kanser gelişim sürecinde ise hipometilasyonlar görülmektedir. Kanserde tümör baskılayıcı genlerin hipermetilasyonu ve onkogenlerin hipometilasyonu ile gelişim sürecine DNA metilasyonu katkı sağlamaktadır. Genomda fazla sayıda hipometilasyon genomda kararsızlığa neden olmaktadır. DNA metilasyonu, ultraviyole ışınları fazlaca emerek DNA’ya karsinojenlerin bağlanmasını arttırmaktadır. Bu durum mutasyon hızını ve gen inaktivasyonunu arttırır. Epigenetik mutasyonlar geri dönüşümlü şekilde gerçekleşebilir. Bu yüzden kanserde epigenetik tedavi yaklaşımlarında demetile edici ajanlar kullanılabilir. 5-azasitidin (azasitidin), 5-aza-2’deoksisitidin (desitabin) ve zebularin kullanılan demetile edici ajanlardır, en fazla hematolojik kanserlerde kullanılmaktadırlar. Bunlar sitozinin yerine DNA’nın yapısına katılırlar. DNMT’ler bu demetile edici ajanları substrat olarak kabul ederler ve aralarında oluşturdukları kovalent bağdan ayrılamazlar. Bunun sonucunda enzim parçalanarak ortamdan uzaklaştırılmış olur. Bunların yanında DNMT inhibitörleri de kullanılmaktadır. DNMT’lerin hedef bölge ile etkileşime geçmesini önleyerek etki göstermektedirler. Epigenetik düzenlenmeler farklı kanser tiplerinde farklı düzenlenme paternleri göstermektedirler. Bu metilasyon kalıplarına bakılarak kanser tiplendirmesi yapmak mümkündür. Bunların yanı sıra kanser tedavisinde gösterilen direnç de promotor bölgesindeki hipermetilasyonlara bağlı bir olgudur. Promotor bölgesindeki hipermetilasyonlar kanser tedavisinde yanıtı etkilemektedir. DNA metilasyonu, kanserin ilerlemesinde ve metastazında oldukça önemli olan epigenetik bir değişimdir. Global DNA hipometilasyonun azalması genellikle prostat kanser ve beyin kanserinde görülmektedir. Promotör DNA hipermetilasyonu, promotör bölgelerinde gerçekleşerek CpG adalarının hipermetile olması ile kanser sürecinde ortaya çıkar. Hücre döngüsünde gen ekspresyonlarının kaderi kromatin düzenlenmesinde yer alan proteinlere bağlıdır. Hücrelerin çevresel etkiler ile farklılaşmaya başladıkları süreçte aktif veya inaktif şekilde bulunan epigenetik işaretler arasında denge bozulur ve kromatinlerin yapısını bozar bu durum tümör başlaması ve ilerlemesinde oldukça önemlidir. Kanserin prognozu ve tedavi sürecinin belirlenmesi oldukça zahmetli bir süreçtir. Bu süreçte kanser biyomarkerı olarak CpG adalarının hipermetilasyon profilleri seçilebilmektedir. Ayrıca DNA metilasyonu ve histon modifikasyonlarındaki epigenetik farklılıkların hedef alınması tedaviye katkı sağlamaktadır. Histon modifikasyonu değişimlerinde görev alan HDAC (deasetilazlar) inhibitörleri (varinostat ve romidepsin) de antikanser ilacı olma özelliği taşımaktadır. 6-9
Kaynaklar:
https://ghr.nlm.nih.gov/primer/howgeneswork/epigenome
https://www2.le.ac.uk/projects/vgec/highereducation/epigenetics_ethics/Introduction#epigenetics-the-environment-and
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3107542/
https://www.ncbi.nlm.nih.gov/books/NBK532999/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3521964/
http://acibadem.dergisi.org/uploads/pdf/pdf_AUD_343.pdf
https://www.nature.com/scitable/definition/histones-57/
https://www.abcam.com/epigenetics/histone-modifications
https://www.journalagent.com/vtd/pdfs/VTD_20_1_48_51.pdf
Kurekci, K, G. Bunsuz, M., Onal, G. Dincer, P. (2017). Kazanılmış Epigenetik Değişikliklerin Kalıtımı ve Hastalıklara Yatkınlıktaki Rolü. İstanbul Tıp Fakültesi Dergisi. 80: 1